1 总 则
1.0.1 为在医药工业洁浄厂房设计中贯彻执行国家有关方针政策,做到技术先进、安全可靠、确保质量、节能环保,制定本标准
1.0.2 本标准适用于新建、扩建和改建的医药工业洁净厂房设计。生物制品、毒性药品、精神药品、麻醉药品以及放射性药品的生产和质量检验设施除应执行本标准外,尚应符合国家有关的监管规定。
1.0.3 医药工业洁净厂房的设计应为施工安装、系统设施验证、维护管理、检修测试和安全运行创造必要的条件
1.0.4 医药工业洁净厂房的设计除应符合本标准外,尚应符合国家现行有关标准规范的规定。
2 术 语
2.0.1 医药洁净室 pharmaceutical clean room
空气悬浮粒子和微生物浓度,以及温度、湿度、压力等参数受控的医药生产房间或限定的空间。
2.0.2 医药工业洁净厂房 pharmaceutical industry clean room
包含医药洁净室的用于药品生产及质量控制的建筑物
2.0.3 人员净化用室room forcleaning personne
人员在进人医药洁净室之前按一定程序进行净化的房间
2.0.4 物料净化用室room forcleaning materia
物料在进入医药洁净室之前按一定程序进行净化的房间
2.0.5 受控环境 controlled environment
以规定方法对污染源进行控制的特定区域
2.0.6 悬浮粒子 airborne particles
用于空气洁净度分级的空气悬浮粒子尺寸范围在0.1um~1000um的固体和液体粒子。
2.0.7 微生物 microorganIsms
能够复制或传递基因物质的细菌或非细菌的微小生物实体。
2.0.8 含尘浓度 particle concentration
单位体积空气中悬浮粒子的数量
2.0.9 含菌浓度 microorganisms concentration
单位体积空气中微生物的数量。
2.0.10 空气洁净度air cleanliness
以单位体积空气中某种粒径的粒子数量和微生物的数量来区分的空气洁净程度。
2.0.11 气流流型 air pattern
空气的流动形态和分布状态。
2.0.12 单向流 unidirectional airflow
通过洁净区整个断面、风速稳定,大致平行的受控气流
2.0.13 非单向流 non-unidirectional airflow
送入洁净区的空气以诱导方式与区内空气混合的一种气流分布。
2.0.14 混合流 mixed airflow
单向流和非单向流组合的气流。
2.0.15 气锁airlock
在医药洁净室出入口,为了阻隔室外或邻室气流、控制压差而设置的房间。
2.0.16 传递柜(窗) pass box
在医药洁净室隔墙上设置的传递物料和工器具的窗口,两侧装有不能同时开启的窗扇。
2.0.17 洁净工作服 clean working garment
医药洁净室内使用的专用工作服
2.0.18 空态 as-built
设施已经建成,所有动力接通并运行,但无生产设备、物料及人员。
2.0.19 静态 at-rest
所有生产设备已经安装就位,但没有生产活动且无操作人员在现场的状态。
2.0.20 动态 In-operation
设施以规定的状态运行,有规定的人员在场,并在商定的状态下工作。
2.0.21 高效空气过滤器 high efficiency particulate air filter
在额定风量下,按最易穿透粒径(MPPS)粒子的捕集效率在99.95%以上的空气过滤器。
2.0.22 医药工艺用水 process water
医药生产工艺过程中使用的水,包括生活饮用水、纯化水、注射用水。
2.0.23 纯化水 purified water
蒸馏法、离子交换法、反渗透或其他适宜的方法制得的,不含任何附加剂,供药用的水,其质量符合现行《中华人民共和国药典》纯化水项下的规定。
2.0.24 注射用水 water for injection
纯化水经蒸馏制得的水,其质量符合现行《中华人民共和国药典》注射用水项下的规定。
2.0.25 自净时间cleanliness recovery characteristic
医药洁净室被污染后,净化空气调节系统在规定的换气次数条件下开始运行,直至恢复到固有的静态标准时所需时间。
2.0.26 恢复时间 recovery time
医药洁浄室生产操作全部结束、操作人员撤出现场,空气中的悬浮粒子达到静态标准时所需时间。
2.0.27 无菌 sterile
没有活体微生物存在
2.0.28 无菌药品 sterile product
法定药品标准中列有无菌检査项目的制剂和原料药
2.0.29 非无菌药品 non-sterile product
法定药品标准中未列有无菌检査项目的制剂和原料药
2.0.30 无菌生产工艺 aseptic processing
必须在无菌控制条件下生产无菌药品的方法
2.0.31 无菌生产核心区core( critical) area of aseptic production
无菌生产工艺过程中,药品和与药品直接接触的包装材料暴露于环境中从而需要特別保护的区域。
2.0.32 无菌生产洁净室 aseptic processing roon
采用无菌生产工艺进行药品生产,并且环境参数受到严格控制的医药洁净室
2.0.33 灭菌sterilize
使产品中微生物的存活概率(即无菌保证水平,SAL)不高于10-6的过程。
2.0.34 浮游菌 airborne viable particles
医药洁净室内悬浮在空气中的活微生物粒子,通过专门的培养基,在适宜的生长条件下,繁殖到可见的菌落数。
2.0.35 沉降菌 sedimental viable particles
用特定的方法收集医药洁净室内空气中的活微生物粒子,通过专门的培养基,在适宜的生长条件下,繁殖到可见的菌落数。
2.0.36 验证 alidation
根据现行《药品生产质量管理规范》(GMP)的原则,证明任何程序、方法、生产工艺、设备、物料、行为或系统确实能导致预期结果的有文件证明的一系列活动。
2.0.37 确认 qualification
证明厂房、设施、设备能正确运行并达到预期结果的一系列活动。
3 生产区域的环境参数
3.1 一般规定
3.1.1 药品生产区域的环境参数应符合现行《药品生产质量管理规范》的规定。
3.1.2 医药洁净室应以微粒和微生物为主要控制对象,同时尚应规定环境的温度、湿度、压差、照度、噪声等参数。
3.1.3 环境空气中不应有异味以及影响药品质量和人体健康的物质。
3.2 环境参数的设计要求
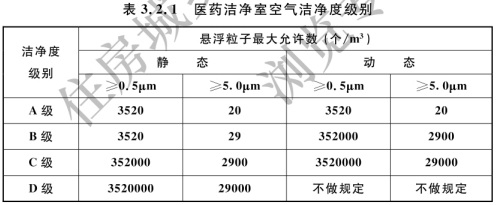
3.2.1 医药洁净室的空气洁净度级别划分应符合表3.2.1的规定。
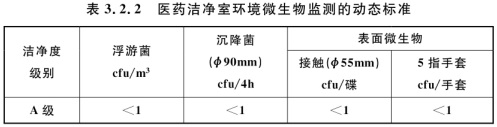
3.2.2 医药洁净室环境微生物监测的动态标准应符合表3.2.2的规定。
以上为标准部分内容,如需看标准全文,请到相关授权网站购买标准正版。






